Fehlerbehebung in der Zellkultur


Die Zellkultur hat sich zu einer der grundlegendsten Techniken für die Modellierung biologischer Systeme entwickelt, gewinnt in der Biotechnologie und der pharmazeutischen Industrie zunehmend an Bedeutung und ist ein wesentlicher Prozess in biowissenschaftlichen Forschungslabors. Obwohl diese Technik leicht zugänglich ist, kann die erfolgreiche Vermehrung von Zellen für Bestandsvergrößerungen oder Modellierungsexperimente durch Kontamination oder andere Bedingungen, die sich negativ auf die Zellviabilität auswirken, beeinträchtigt werden. Die gängige Praxis der gemeinsamen Nutzung von Zellen hat zu gut dokumentierten Nachweisen für eine Kreuzkontamination von Zellbeständen geführt, deren Identität zuvor nicht angezweifelt wurde. Die Identifizierung von häufig und selten auftretenden Gründen, warum Zellen sich nicht vermehren, kann die Laboreffizienz erhöhen, die Ausbeute zellulärer Produkte verbessern und aussagekräftige, zuverlässige Daten aus In-vitro-Modellen sicherstellen.

Falsche Identifizierung von Zelllinien
In aktuellen Studien wird davon ausgegangen, dass eine falsche Identifizierung bis zu einem Drittel aller verwendeten Zelllinien betreffen kann. Diese Entdeckungen haben das Potenzial, veröffentlichte Erkenntnisse über biologische Systeme, die auf Ergebnissen von Zelllinienmodellen beruhen, in Frage zu stellen. Zu den Faktoren, die zu einer falschen Identifizierung/Kreuzkontamination von Zelllinien führen, gehören:
- Kontamination mit aggressiven Zelllinien: Isoenzymanalysen haben gezeigt, dass viele Zelllinien eine seltene Isoform des Enzyms mit HeLa-Zellen teilen. HeLa hat sich seitdem als die häufigste invasive Zelllinie in Kulturbeständen erwiesen.
- Dokumentations- und Kennzeichnungspraktiken: Zellkulturflaschen, Platten, Kryoröhrchen und Gefrierbehälter müssen klar gekennzeichnet sein und die Karten für die Lagerung von Flüssigstickstoff müssen genauestens geführt werden, um die Zugabe, Entnahme und Verlagerung von Zellbeständen zu dokumentieren.
- Ausleihen von Zelllinien: Die gemeinsame Nutzung von Zellen durch benachbarte Labore ist eine gängige Praxis, die zu Fehlern bei der Zelllinienidentität führen kann. Zelllinien sollten nur aus seriösen Zellsammlungen wie der Europäischen Sammlung authentifizierter Zellkulturen ECACC, Public Health England, bezogen werden.
Informieren Sie sich über häufige Ursachen von Zelllinien-Kreuzkontaminationen und darüber, wie Sie Ihre Arbeit vor deren Folgen schützen können.

Mikrobielle Kontamination von Zellkulturen
Zellkulturmedien und Inkubationsbedingungen bieten ein ideales Umfeld für Zellen sowie für bakterielle, virale und Schimmelpilzkontaminationen. Um die sorgfältige Einhaltung der aseptischen Kulturtechnik zu unterstützen, müssen die Kulturen regelmäßig mikroskopisch auf Anzeichen von Verunreinigungen durch Bakterien oder Schimmelpilze untersucht werden. Einige allgegenwärtige mikrobiologische Kontaminationen können visuell nicht nachgewiesen werden, da schätzungsweise bis zu 30 % aller Kulturen mit Mykoplasmen kontaminiert sind. Reagenzien und Kits für den Nachweis unsichtbarer Mykoplasmen basieren häufig auf der PCR-Amplifikation, die auch zum Nachweis von Viruskontaminationen verwendet werden kann.

Schlechtes Zellwachstum
Es ist frustrierend, wenn Zellen in Kultur, die ansonsten gesund erscheinen, keine Konfluenz erreichen. Wenn Verunreinigungen ausgeschlossen sind, gibt es einige weitere mögliche Hindernisse für eine gesunde Zellverdopplung:
- Zustand und Qualität der Kultur-/Gefriermedien
- Qualität und Anwendungseignung von Supplementen
- Ungenaue Zellauszählung in Gefriervorgang oder Passage
Wenn Zellen lebensfähig erscheinen, sich aber nicht ausbreiten, können Sie sich hier informieren, was Sie tun können, um die Kulturbedingungen für ein optimales Wachstum zu verbessern, bevor Sie auf flüssigen Stickstoff zurückgreifen.

Ablösung adhärenter Zellphänotypen
Adhärente Zellen können sich in der Kultur spontan entweder einzeln oder in Platten ablösen. Es ist wichtig zu wissen, worauf Sie achten müssen und wie Sie den Zusammenhalt in der Kultur wiederherstellen können, wenn eine adhärente Kultur ihre Beschaffenheit verliert.
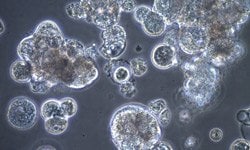
Zellverklumpung
Zellen in Suspension ahmen die In-vivo-Bedingungen als Einzelzellen nach. Wenn Zellen zu verklumpen beginnen, kann dies auf klebrige Nukleinsäuren zurückzuführen sein, die im Medium vorhanden sind, wenn die Kulturen gestresst sind. Was verbirgt sich in den Medien, das eine Verklumpung der Zellen verursachen kann? Lesen Sie hier mehr darüber, wie Sie Verklumpungen in Kulturen vermeiden können.

Zelltod in der Kultur
Wenn Zellen in der Kultur absterben, muss zunächst eine Kontamination mit Mikroorganismen ausgeschlossen werden. Weitere Faktoren, die zu einer schlechten Zellgesundheit oder einem Verhalten, das nicht mit dem Phänotyp übereinstimmt, beitragen können, sind u. a:
- Gefriergutbedingungen
- Anzahl der Zellpassagen / Zu hohe Konfluenz
- Umfeldbelastung
- Zu hoher Verdau mit dissoziierten Enzymen
Geeignete Geräte, qualifizierte Reagenzien und Expertenprotokolle sind der Schlüssel zur Behebung unerwarteter Zellkulturresultate.

Ausfällungen in Nährmedien
Wenn es sich nicht um eine Kontamination handelt, haben die Partikel in der Kultur oft eine anorganische Ursache. Erfahren Sie mehr über ausgewogene Puffer und Medienbestandteile und darüber, wie Medienbestandteile suspendiert bleiben.
Zugehörige technische Artikel
- Cell culture antibiotic selection guide, including antibiotics for mammalian cell culture, plant cell culture, and antibiotic selection agents for cell culture.
- What is endotoxin? Frequently asked questions about bacterial endotoxin contamination of in vitro cell cultures. Details about how to endotoxin test using the LAL assay, common sources of laboratory endotoxin contamination and tips on how to avoid endotoxin contamination when culturing cell lines.
- Extracellular matrix proteins such as laminin, collagen, and fibronectin can be used as cell attachment substrates in cell culture.
- Alle anzeigen (21)
Zugehörige Protokolle
- This technical article covers the protocol for how to properly harvest cells from Corning® CellSTACK® culture chambers.
- Cell culture protocol for proper thawing of cryopreserved cell lines.
- Cell culture protocol for passaging and splitting adherent cell lines using trypsin EDTA. Free ECACC handbook download.
- Cell culture protocol for freezing cell lines at high cell viabilities using cryopreservation reagents such as DMSO. Cryopreservation is a method whereby cells are frozen, maintaining their viability, until they are defrosted months or years later. Free ECACC handbook download.
- Protocol for the seeding and cultivation of primary cells received in cryopreserved or proliferating formats. Information on primary cell culture, cell handling and passaging.
- Alle anzeigen (2)
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?