MAB3392
Anticuerpo anti-colágeno tipo III, clon-IE7-D7
clone 1E7-D7, from mouse
Sinónimos:
collagen, type III, alpha 1, collagen, fetal, Ehlers-Danlos syndrome type IV, autosomal dominant, alpha1 (III) collagen, collagen alpha-1(III) chain
About This Item
Productos recomendados
biological source
mouse
Quality Level
antibody form
purified immunoglobulin
antibody product type
primary antibodies
clone
1E7-D7, monoclonal
species reactivity
rat
species reactivity (predicted by homology)
human (based on 100% sequence homology)
technique(s)
ELISA: suitable
immunohistochemistry: suitable
western blot: suitable
isotype
IgG1κ
NCBI accession no.
UniProt accession no.
shipped in
wet ice
target post-translational modification
unmodified
Gene Information
human ... COL3A1(1281)
General description
Specificity
Immunogen
Application
Análisis mediante inmunoelectrotransferencia (WB): un lote anterior de este anticuerpo se utilizó para detectar el colágeno tipo III en inmunoelectrotransferencia en condiciones no reducidas (Werkmeister J.A., et al., 1988; Ramshaw, J.S., et al., 1988).
Algunas muestras de colágeno pueden estar contaminadas con otros tipos de colágeno. Cuando se utiliza colágeno purificado en una aplicación, la pureza de la muestra de colágeno debe ser verificada por SDS-PAGE para minimizar el riesgo de falsos positivos.
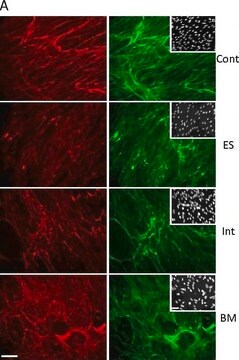
Análisis mediante inmunohistoquímica: un lote anterior de este anticuerpo se utilizó para detectar el colágeno tipo III en inmunohistoquímica (Werkmeister J.A., et al., 1989; Werkmeister J.A., et al., 1989; Werkmeister J.A., et al., 1988).
Estructura celular
Proteínas de la ECM
Quality
Análisis mediante inmunohistoquímica: una dilución 1:600 de este anticuerpo detectó el colágeno de tipo III en tejido de la articulación de rodilla de rata.
Target description
Physical form
Storage and Stability
Analysis Note
Tejido articular de la rodilla de rata
Other Notes
Disclaimer
¿No encuentra el producto adecuado?
Pruebe nuestro Herramienta de selección de productos.
Storage Class
12 - Non Combustible Liquids
wgk_germany
WGK 1
flash_point_f
Not applicable
flash_point_c
Not applicable
Certificados de análisis (COA)
Busque Certificados de análisis (COA) introduciendo el número de lote del producto. Los números de lote se encuentran en la etiqueta del producto después de las palabras «Lot» o «Batch»
¿Ya tiene este producto?
Encuentre la documentación para los productos que ha comprado recientemente en la Biblioteca de documentos.
Nuestro equipo de científicos tiene experiencia en todas las áreas de investigación: Ciencias de la vida, Ciencia de los materiales, Síntesis química, Cromatografía, Analítica y muchas otras.
Póngase en contacto con el Servicio técnico