세포 생존성 및 증식 분석법
소개
세포 증식, 세포 생존성, 세포 독성을 측정하는 분석법은 일반적으로 다양한 자극물로 처리한 후 배양 세포의 반응과 건강 상태를 모니터링하는 데 사용됩니다. 적절한 분석 방법 선택은 사용되는 세포 수와 유형 및 기대하는 결과에 따라 달라집니다. 세포 증식 분석법은 시간 경과에 따른 세포 수, 세포 분열 수, 대사 활동 또는 DNA 합성을 모니터링할 수 있습니다. 트리판 블루 또는 Calcein-AM 같은 생존성 염료를 사용한 세포 카운팅은 증식 속도뿐 아니라 생존 가능한 세포의 백분율도 제공할 수 있습니다.
세포 생존성 및 증식 분석법 개요

그림 1.A - BrdU 염색을 사용하여 E4 병아리 배아 눈의 증식 중인 세포. B - 캄프토테신을 사용한 항 BrdU 항체 검증 Jurkat 세포를 세포 주기 정지 시약 캄프토테신으로 처리하여 혈중 세포가 G1/S 상전이에 트랩됩니다.
EdU 증식 분석법
Baseclick EdU 증식 분석법은 복제 DNA의 형광 검출을 위한 효율적인 방법을 제공합니다. 수정된 뉴클레오시드 EdU가 살아 있는 세포에 첨가되고 복제 DNA에 결합됩니다. Cu-유도 클릭 화학을 통해 형광 프로브가 EdU에 빠르게 부착될 수 있습니다. 이는 증식 중인 세포를 모니터링하는 정량적 방법을 제공합니다. 이 분석법은 마이크로 영상, 유세포 분석, 고효율 스크리닝, 생체 내 실험에 다양한 형식으로 사용할 수 있습니다. 최대 여기가 488, 555, 594, 647인 네 가지 형광 프로브를 다른 형광 프로브와 함께 다중화 기능에 사용할 수 있습니다.

그림 2.Edu-Click 세포 증식 키트는 활성 DNA 합성 중에 EdU(5-ethynyl-2’-deoxyuridine)를 DNA에 결합하며, 클릭 화학 형광 검출 방법을 사용하여 측정됩니다.
대사 증식 분석법
대사 활동을 측정하는 분석법은 증식, 생존성, 세포 독성을 분석하기에 적합합니다. MTT, XTT, WST-1 등 테트라졸륨염의 유색 포르마잔 화합물로의 환원 또는 레자주린의 생물 환원은 대사 활동이 있는 세포에서만 발생합니다. 활동적으로 증식하는 세포는 대사 활동을 증가시키는 반면 독소에 노출된 세포는 활동이 감소합니다.
MTT 세포 증식 분석법
MTT(3-[4,5-dimethylthiazol-2-yl]-2,5- diphenyltetrazolium bromide; thiazolyl blue)는 페놀 레드가 없는 배지 또는 식염수에서 준비하는 경우 노르스름한 용액을 만들어내는 수용성 테트라졸륨염입니다. 용해된 MTT는 탈수소 효소에 의한 테트라졸륨 링의 절단을 통해 불용성 보라색 포르마잔으로 변환됩니다. 물에 녹지 않는 이 포르마잔은 이소프로판올 또는 기타 용제를 사용하여 가용화될 수 있으며, 녹은 물질은 흡광도를 변환된 염료 농도의 함수로 사용하여 분광 광도 측정이 가능합니다.
XTT 세포 증식 분석법
MTT와 대조적으로 XTT의 절단 산물은 물에 녹습니다. 따라서 가용화 단계는 필요하지 않습니다. 테트라졸륨염 XTT는 복잡한 세포 기전에 의해 포르마잔으로 절단됩니다. 이 생물 환원은 생존 세포에서만 발생하며, 당분해를 통해 NAD(P)H 생성과 관련됩니다. 직접 형성되는 포르마잔 염료의 양은 배양의 대사 활성 세포 수와 상관 관계가 있습니다.
WST-1 세포 증식 분석법
안정적인 테트라졸륨염인 WST-1은 주로 세포 표면에서 발생하는 복잡한 세포 기전에 의해 가용성 포르마잔으로 절단됩니다. 이 생물 환원은 주로 생존 세포에서의 NAD(P)H의 당분해 생성에 좌우됩니다. 직접 형성되는 포르마잔 염료의 양은 배양의 대사 활성 세포 수와 상관 관계가 있습니다.
프로토콜 지침: 세포 생존성 및 증식용 WST-1 분석법. 프로토콜, FAQ, 문제 해결

그림 3.MTT 분석법은 대사 활동을 기반으로 세포 증식을 평가하기 위한 비색 분석법입니다. NAD(P)H-의존 세포 산화 환원 효소는 존재하는 생존 세포 수를 반영합니다. 이러한 효소는 노란색 테트라졸륨 염료 MTT 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide를 보라색의 불용성 포르마잔으로 환원시킬 수 있습니다.
발광 세포 생존성 분석법
ATP는 대사 활성 세포의 지표이기 때문에 사용 가능한 ATP의 양을 기준으로 생존 세포 수를 평가할 수 있습니다. ATP 세포 생존성 루시페라제 분석법은 세포 배양의 ATP를 정량화하는 고감도 균질법을 제공합니다. 이 키트는 반딧불이 루시페라제를 사용하여 D-루시페린을 산화시키고 그로 인한 빛 생성을 사용하여 세포 배양에서 사용 가능한 ATP 양을 평가합니다. 민감한 분석법 절차에서는 ATP 검출 칵테일을 혈청 첨가 배지에서 배양한 세포에 직접 1회 첨가해야 합니다. 세포 세척, 배지 제거 또는 다중 피펫팅은 필요하지 않습니다. 키트는 단세포 또는 ATP 0.01 피코몰을 검출할 만큼 민감합니다. 생성되는 신호는 100만 배 이내에서 선형입니다. 이 분석법은 ATP 양을 생존 세포 수와 연결시켜 생존 세포 수부터 세포 증식 및 세포 독성에 이르는 다양한 응용분야를 가지고 있습니다.

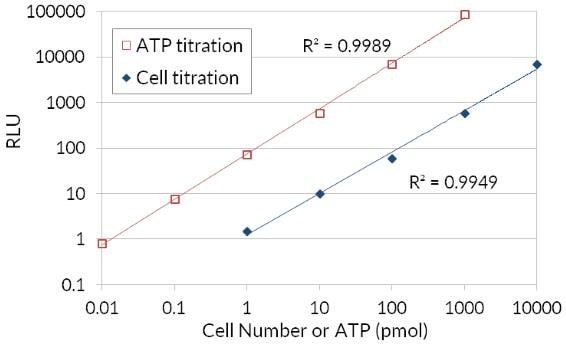
그림 4.생물 발광 ATP 루시페라제 세포 생존성 분석법 반딧불이 루시페라제의 ATP를 사용하여 D-루시페린을 산화시키고 그로 인한 빛 생성을 통해 세포 수와 생존성을 연관시키는 사용 가능한 ATP 양을 평가합니다.
형광 염색 증식 분석법
CFSE 표지화
5(6)-Carboxyfluorescein diacetate N-succinimidyl ester(CFSE)는 세포 집단이 겪는 분열 수 측정에 자주 선택됩니다. CFSE는 세포에 진입하면 세포 내 에스테라제에 의해 절단되어 형광 화합물을 형성하고, 숙시니미딜 에스테르 그룹은 세포 내 단백질에서 1차 아민에 공유 결합으로 반응합니다. 분열 시 각 딸 세포의 형광 강도는 절반이 되어 유동 세포 분석에 의한 세포 분열 수를 간단히 검출할 수 있습니다. CFSE는 T 세포를 포함한 림프구 증식을 측정하는 데 널리 사용되어 왔습니다.
생존/사멸 세포 이중 염색
생존/사멸 세포 이중 염색은 생존 세포와 사멸 세포의 동시 형광 검출에 활용할 수 있습니다. Calcein-AM은 친유성이 높은 세포 멤브레인 투과 염료입니다. Calcein-AM 자체는 형광 분자가 아니지만 생존 세포의 에스테라제에 의해 Calcein-AM에서 생성되는 칼세인은 강한 녹색 형광(λex 490 nm, λem 515 nm)을 방출합니다. 따라서 Calcein-AM은 생존 세포만 염색합니다. 반면 핵 염색 염료인 Propidium Iodine은 생존 세포 멤브레인을 통과할 수 없습니다. 이 염료는 죽은 세포 멤브레인의 와해된 영역을 통과하여 핵에 도달하며, DNA 이중 나선에 삽입되어 빨간색 형광(λex 535 nm, λem 617 nm)을 방출합니다. Calcein과 PI-DNA 모두 490 nm 빛으로 여기시킬 수 있기 때문에 단일 여기 형광 현미경으로 생존 세포와 사멸 세포의 동시 모니터링이 가능합니다.

그림 5.생존/사멸 세포 이중 염색
3D 세포 배양- 생존/사멸/총 세포 3중 염색
Cell Viability Imaging Kit는 생존 세포(Calcein-AM), 사멸 세포(Propidium Iodide/PI) 및 총 세포(Hoechst 33342)의 동시 형광 염색에 2D 및 3D 세포 배양과 함께 사용할 수 있는 3색 분석법입니다.
- Calcein-AM은 대사 활동이 있는 생존 세포에만 존재하는 에스테라제 활동에 의존하여 결합 칼슘에서 녹색 형광을 방출합니다.
- Propidium Iodide(PI)는 생존 세포의 멤브레인에 의해 차단되지만 사멸 세포의 손상된 멤브레인을 통과해 DNA에 삽입되어 강한 빨간색 형광을 방출하는 핵 염료입니다.
- Hoechst 33342는 낮은 세포 독성을 보이는 DNA 염색 염료입니다. 파란색 형광을 방출하며 총 세포 수의 지표로 사용됩니다.
트리판 블루 세포 카운팅
트리판 블루는 생존 세포 카운팅의 염료 제외 절차에서 사용하도록 권장되는 몇 가지 염료 중 하나입니다. 이 방법은 살아 있는(생존) 세포가 파란색 염료를 흡수하지 않는 반면 죽은(비생존) 세포는 흡수한다는 원리에 기반합니다. 세포 생존성은 총 생존 세포/총 세포(생존 세포와 사멸 세포)의 비를 사용하여 계산할 수 있습니다. 염색은 전체 세포 형태의 시각화도 촉진합니다.
참고: 트리판 블루는 세포 단백질보다 혈청 단백질 친화력이 더 높습니다. 기질에 혈청이 존재하기 때문에 배경이 너무 어두운 경우 카운팅 전에 세포를 팰릿하고 단백질이 없는 배지 또는 식염수에서 재현탁해야 합니다.

그림 6.혈구계와 트리판 블루를 사용한 세포 카운팅
참고문헌
계속 읽으시려면 로그인하거나 계정을 생성하세요.
계정이 없으십니까?