A6680
N-Acetylneuraminsäure-Aldolase aus E. coli
lyophilized powder, ≥20 units/mg protein (biuret)
Synonym(e):
N-Acetylneuraminat-Pyruvat-Lyase, N-Acetylneuraminsäure-Lyase, NANA-Aldolase, Sialyl-Aldolase
About This Item
Empfohlene Produkte
Form
lyophilized powder
Spezifische Aktivität
≥20 units/mg protein (biuret)
Mol-Gew.
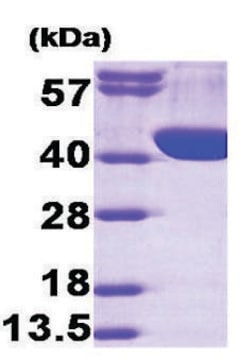
~98 kDa
Lagertemp.
−20°C
Suchen Sie nach ähnlichen Produkten? Aufrufen Leitfaden zum Produktvergleich
Anwendung
coupled with the related enzymes in clinical analysis.
For industrial use, this enzyme is useful for enzymatic synthesis of sialic acid.
Physikalische Eigenschaften
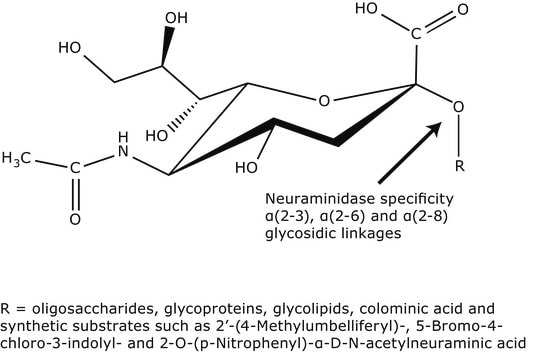
Michaelis constant: 2.5 x 10‾3M (N-Acetylneuraminic acid)
Structure: 3 subunits (approx. 35,000) per mol of enzyme
Inhibitors: p-Chloromercuribenzoate, sodium dodecyl sulfact, Hg++, Ag+
Optimum pH: 7.5– 8.0
Optimum temp: 70°C
pH Stability: pH 6.0–9.0 (10°C, 25hr)
Thermal stability: Below 65°C (pH 7.5, 30 min)
Einheitendefinition
Physikalische Form
Lagerklassenschlüssel
10 - Combustible liquids
WGK
WGK 3
Flammpunkt (°F)
Not applicable
Flammpunkt (°C)
Not applicable
Persönliche Schutzausrüstung
Eyeshields, Gloves, multi-purpose combination respirator cartridge (US)
Analysenzertifikate (COA)
Suchen Sie nach Analysenzertifikate (COA), indem Sie die Lot-/Chargennummer des Produkts eingeben. Lot- und Chargennummern sind auf dem Produktetikett hinter den Wörtern ‘Lot’ oder ‘Batch’ (Lot oder Charge) zu finden.
Besitzen Sie dieses Produkt bereits?
In der Dokumentenbibliothek finden Sie die Dokumentation zu den Produkten, die Sie kürzlich erworben haben.
Unser Team von Wissenschaftlern verfügt über Erfahrung in allen Forschungsbereichen einschließlich Life Science, Materialwissenschaften, chemischer Synthese, Chromatographie, Analytik und vielen mehr..
Setzen Sie sich mit dem technischen Dienst in Verbindung.