C-H-Funktionalisierung
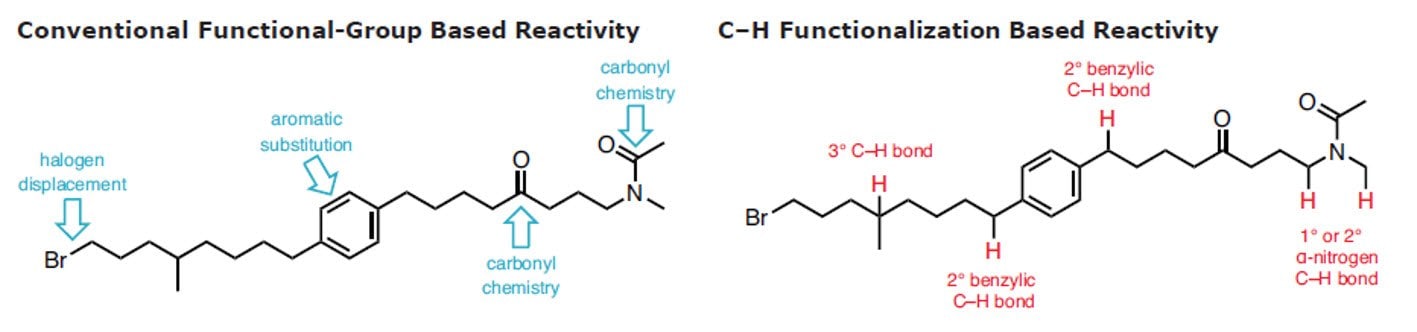
Die C-H-Funktionalisierung wurde als heiliger Gral der synthetischen organischen Chemie bezeichnet.1 Aktuelle Bemühungen in der organischen und metallorganischen Chemie und der Katalyse haben zu ernsthaften Fortschritten beim Verständnis der Reaktivität von C-H-Bindungen und bei der Entwicklung robuster Reaktionen geführt, bei denen Vorteil aus diesen Erkenntnissen gezogen wird. Dies deutet darauf hin, dass es an der Zeit ist, diese Taktik auf breiter Basis in die Retrosynthese aufzunehmen.2-11 Die zuverlässige und vorhersagbare Umwandlung einer C-H- in eine C-C-, C-N-, C-O- oder C-X-Bindung auf selektive und kontrollierte Weise ist im Hinblick auf die Einsparung von Arbeitsschritten und die Verringerung von Abfällen von Vorteil.
Durch neuartige Methoden zur C-H-Aktivierung wird die Anzahl der Stellen, die in einem bestimmten Molekül anvisiert werden können, erweitert und die Möglichkeit erhöht, es zu einem komplexeren Produkt weiterzuentwickeln. Darüber hinaus lassen sich in der organischen Synthese ganz unterschiedliche Arten chemischer Bindungen anvisieren, insbesondere mit hoher Chemoselektivität. In Kombination mit der traditionellen Chemie der funktionellen Gruppen vereinfacht die C-H-Funktionalisierung die chemische Synthese zur Herstellung komplexer Naturstoffe und pharmazeutischer Verbindungen erheblich. Obwohl die Anwendung der Logik der C-H-Funktionalisierung eindeutig Vorteile bietet,12 sind viele Curricula für die organische Chemie noch nicht auf diesen Ansatz abgestimmt. Weitere Informationen hierzu finden Sie im Handbuch zur C-H-Funktionalisierung.
Zugehörige technische Artikel
- Professor Karl Anker Jørgensen and his group have developed ethers which serve as excellent chiral organocatalysts in the direct asymmetric α-functionalization of aldehydes.
- The synthesis of heteroaromatic and aromatic compounds is at the heart of the chemical industry. The ever-growing demand for new chemical entities, coupled with dwindling resources and time constraints allotted to any given research project, a rapid way to diversify (hetero)aromatic scaffolds is needed.
- The Du Bois group at Stanford University has made substantial progress within the field of Rh-catalyzed C–H amination via oxidative cyclization of carbamate, sulfamate, sulfamide, urea, and guanidine substrates to give 1,2- and 1,3-heteroatom motifs masked in the form of 5- and 6-membered ring heterocycles.
- Aryl chlorides are commonly used in cross-coupling reactions and can serve as key intermediates towards the synthesis of pharmaceutical drug candidates and natural products.
- A recyclable, ligand-free ruthenium catalyst for C–H activation reactions and concomitant C–C bond formation in the presence of water.
- Alle anzeigen (10)
Literatur
Um weiterzulesen, melden Sie sich bitte an oder erstellen ein Konto.
Sie haben kein Konto?